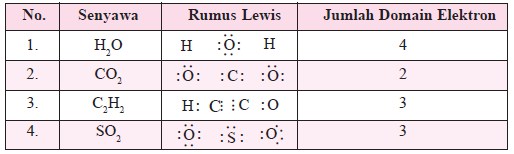
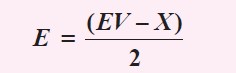Bentuk Molekul

Domain berarti wilayah atau daerah. Domain elektron berarti suatu wilayah yang ditempati oleh elektron. Adapun elektron yang dimaksud di sini adalah elektron dari atom-atom pembentuk molekul, meliputi pasangan elektron bebas (PEB) dan pasangan elektron ikatan (PEI). Sebuah molekul memiliki bentuk atau struktur yang berbeda dengan struktur molekul lain. Bentuk molekul berarti cara atom tersusun di dalam ruang. Bentuk molekul ini banyak memengaruhi sifat-sifat fisis dan kimia dari molekul tersebut, khususnya dalam reaksi kimia. Ketika dua molekul dicampurkan untuk bereaksi, ada kemungkinan reaksi tidak berhasil dikarenakan struktur tiga dimensi dan orientasi relatif molekul-molekul tersebut tidak tepat. Dalam reaksi biologi, terutama pada obat dan aktivitas enzim, struktur molekul sangat penting untuk mengetahui kecocokan antara bentuk molekul dengan tapak atau membran yang dipakai. (Baca juga : Gaya Antar Molekul)
Bentuk molekul adalah gambaran tentang susunan atom-atom dalam molekul berdasarkan susunan ruang pasangan elektron dalam atom atau molekul, baik pasangan elektron yang bebas maupun yang berikatan.
Bentuk suatu molekul dapat diperkirakan berdasarkan teori tolakan pasangan elektron maupun teori hibridisasi. Bagaimanakah bentuk suatu molekul berdasarkan teori tersebut? Perhatikan uraian berikut.
1. Teori Tolakan Pasangan Elektron
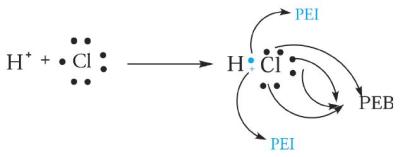
Konsep yang dapat menjelaskan bentuk geometri (struktur ruang) molekul dengan pendekatan yang tepat adalah Teori Tolakan Pasangan Elektron Valensi (Valence Shell Electron Pair Repulsion = VSEPR). Teori ini disebut juga sebagai Teori Domain Elektron. Teori Domain dapat menjelaskan ikatan antar atom dari PEB dan PEI yang kemudian dapat mempengaruhi bentuk molekul. Dalam teori ini dinyatakan bahwa “pasangan elektron terikat dan pasangan elektron bebas, yang secara kovalen digunakan bersama-sama di antara atom akan saling menolak, sehingga pasangan itu akan menempatkan diri sejauh-jauhnya untuk meminimalkan tolakan”. Teori VSEPR pertama kali dikembangkan oleh ahli kimia dari Kanada, R.J. Gillespie (1957). Bentuk molekul dan strukturnya dapat diramalkan dengan tepat melalui Struktur Lewis. Struktur ini dapat menggambarkan bagaimana elektron tersusun pada suatu atom yang berikatan. Sebagat contoh adalah ikatan kovalen pada molekul HC1 (Gambar 1). Struktur Lewis juga dapat menggambarkan jumlah pasangan elektron bebas dan jumlah pas-angan elektron ikatan yang berada di sekitar atom pusat.
Gambar 1. PEI dan PEB pada ikatan kovalen molekul HCl.
Teori VSEPR tidak menggunakan orbital atom dalam meramalkan bentuk molekul, tetapi menggunakan titik elektron suatu atom. Jika suatu atom bereaksi, maka elektron pada kulit terluar (elektron valensi) akan bcrhubungan langsung terlebih dahulu. Elektron valensi akan menentu-kan bagaimana suatu ikatan dapat terjadi.
Teori VSEPR menjelaskan terjadinya gaya tolak-menolak antara pasangan-pasangan elektron pada kulit terluar atom pusat.
Masih ingatkah kalian dcngan jumlah elektron yang mcncmpati suatu orbital? Apakah yang dimaksud dengan rumus duplet dan rumus oktet?
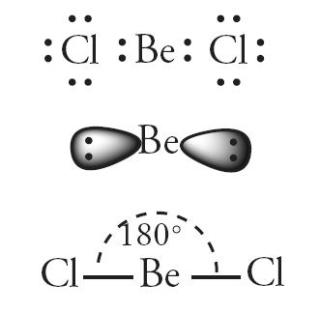
Pada setiap orbital terdapat sejumlah elektron. Ikatan antar atom terjadi karena kecenderungan atom untuk memenuhi rumus duplet dan rumus oktet. Duplet berarti mcmiliki 2 elektron, scdangkan oktrt menandakan suatu atom memiliki 8 elektron. Bagaimana cara meramalkan bentuk molekul dengan titik elektron? Pengaturan pasangan elektron di sekitar atom sedemikian rupa sehingga tolakan di antara pasangan elektron itu minimum. Tolakan minimum tcrjadi bila elektron terletak pada bagian yang saling bcrlawanan terhadap inti. Perhatikan molekul BeC12 pada Gambar 2.
Gambar 2. Bentuk molekul BeC12 berupa linear.
Terdapat 2 elektron yang terletak berlawanan pada orbital berupa balon terpilin. Molekul BeC12 berbentuk linear dengan sudut 1800. Bagaimana dengan b
entuk molekul lain, semisal SO2 dan BC13? Perhatikan Gambar 3. dan 4.
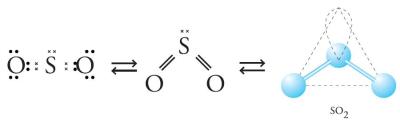
Gambar 3. Bentuk molekul SO2 berupa V.
lkatan kovalen adalah ikatan yang terjadi karena pemilikan bersama pasangan elektron berikatan yang merupakan sum-bangan dari kedua atom atau salah satunya.
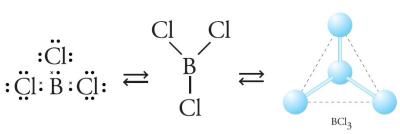
Gambar 4. Bentuk molekul BC13 berupa segitiga datar.
Teori VSEPR berhasil menjelaskan bentuk molekul. Ketepatan daya prediksi teori VSEPR relatif sangat tinggi, khususnya untuk molekul-molekul yang pusatnya atom non-logam. (www.unibookstore.stie-mce.ac.id)
Mengapa struktur SO2 berbeda dengan struktur BeC12? Mengapa pula berbeda dengan struktur BC13. Penjelasan berikut akan memberikan jawabannya.
Tolakan minimum didapat dengan meletakkan elektron pada bagian yang berlawanan. Tolakan minimum pada mulekul BC13 dengan atom B sebagai atom pusat didapat dengan bentuk segitiga. Adapun pada molekul SO2 terdapat 3 kelompok elektron, yang salah satunya adalah PEB dari atom S. Adanya elektron bebas ini akan mendesak atau mendorong elekron ikatan untuk saling berdesakan, sehingga bentuk molekul menjadi bentuk V.
Urutan tolak-menolak antara pasangan elektron pada atom pusat dapat diurutkan sebagai: PEB-PEB > PEI-PEB > PEI-PEI.
PEB mempunyai gaya tolak-menolak sejauh mungkin sehingga tolakannya minimum. Perbedaan kekuatan tolakan PEB dan PEI menyebabkan penyimpangan dalam susunan ruang elektron dari bentuk molekul yang seharusnya.
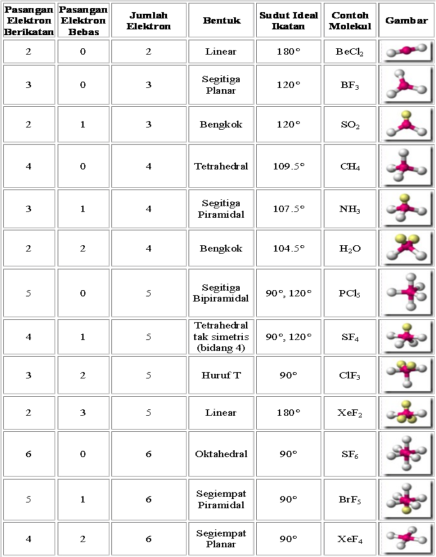
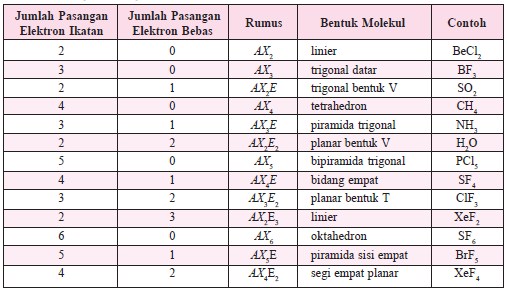
Apabila pada molekul BC12 atom pusat B dinotasikan dengan M, sedangkan ikatan dengan Cl yang terjadi dengan 2 pasang elektron ikatan dinotasikan dengan X2, maka molekul BC12 dan molekul sejenis dinotasikan dengan MX2. SO2 dinotasikan dengan MX2E, dengan E menunjukkan jumlah pasangan pa sangan elektron bebas. Notasi semacam ini disebut sebagai notasi VSEPR. Perhatikan notasi VSEPR dan bentuk molekul beberapa senyawa pada Tabel 1.
Cara Menentukan Bentuk Molekul Berdasarkan Teori VSEPR
Tentukan atom pusatnya.
Cari tahu nomor atomnya dan buat konfigurasi elektronnya.
Tentukan jumlah elektron valensinya.
Tentukan jumlah domain elektron dari atom lain yang berikatan (ligan).
Jumlahkan elektron dari semua atom.
Bagilah dua untuk mendapatkan jumlah pasangan elektron.
Tentukan PEI berdasarkan jumlah atom yang terikat pada atom pusat, sisanya merupakan PEB.
Tentukan notasi VSEPR dan bentuk molekul berdasarkan jumlah PEB dan PEI (lihat tabel 1. sebagai acuan).
2. Teori Domain Elektron
Teori domain elektron merupakan penyempurnaan dari teori VSEPR. Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron, dengan jumlah domain ditentukan sebagai berikut (Ralph H. Petrucci, 1985).
Setiap elektron ikatan (baik itu ikatan tunggal, rangkap, atau rangkap tiga) berarti 1 domain.
Setiap pasangan elektron bebas berarti 1 domain.
Prinsip-prinsip Dasar Teori Domain Elektron
Teori domain elektron mempunyai prinsip-prinsip dasar sebagai berikut (Ralph H. Petrucci, 1985):
1. Antardomain elektron pada kulit luar atom pusat saling tolak-menolak sehingga domain elektron akan mengatur diri (mengambil formasi) sedemikian rupa, sehingga tolak-menolak di antaranya menjadi minimum. Susunan ruang domain elektron yang berjumlah 2 hingga 6 domain yang memberi tolakan minimum, dapat dilihat pada tabel di bawah.
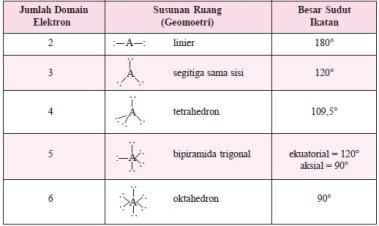
Urutan kekuatan tolak-menolak di antara domain elektron adalah:
tolakan antardomain elektron bebas > tolakan antara domain elektron bebas dengan domain elektron ikatan > tolakan antardomain elektron ikatan.
Perbedaan daya tolak ini terjadi karena pasangan elektron bebas hanya terikat pada satu atom saja, sehingga bergerak lebih leluasa dan menempati ruang lebih besar daripada pasangan elektron ikatan. Akibat dari perbedaan daya tolak tersebut adalah mengecilnya sudut ikatan karena desakan dari pasangan elektron bebas. Hal ini juga terjadi dengan domain yang mempunyai ikatan rangkap atau rangkap tiga, yang pasti mempunyai daya tolak lebih besar daripada domain yang hanya terdiri dari sepasang elektron.
Bentuk molekul hanya ditentukan oleh pasangan elektron terikat.
Jumlah domain (pasangan elektron) dalam suatu molekul dapat dinyatakan sebagai berikut.
Atom pusat dinyatakan dengan lambang A.
Domain elektron ikatan dinyatakan dengan X.
Domain elektron bebas dinyatakan dengan E.
Tipe molekul dapat dinyatakan dengan menggunakan langkah-langkah sebagai berikut.
Menentukan jumlah elektron valensi atom pusat (EV).
Menentukan jumlah domain elektron ikatan (X).
Menentukan jumlah domain elektron bebas (E).
Contoh Soal Teori Domain Elektron
Tentukan tipe molekul dari senyawa-senyawa biner berikut ini:
a. BF3
b. PCl3
c. ClF3
Jawab:
a. Jumlah elektron valensi atom pusat (boron) = 3
Jumlah domain elektron ikatan (X) = 3
Jumlah domain elektron bebas
Tipe molekul: AX3.
Cara penetapan tipe molekul dengan menggunakan langkah-langkah di atas hanya berlaku untuk senyawa biner berikatan tunggal. Untuk senyawa biner yang berikatan rangkap atau ikatan kovalen koordinasi, maka jumlah elektron yang digunakan untuk membentuk pasangan terikat menjadi dua kali jumlah ikatan.